Einleitung
Im folgenden Experiment wollen wir die Estersynthese von Salicylsäure und Butanol experimentell untersuchen und drei unterschiedliche Reagenzien vergleichen, um das Gleichgewicht schneller einzustellen. Saurer homogener Katalysator( Schwefelsäure), saurer heterogener Katalysator( Amberlyst) und ein hygroskopisches Salz um Wasser aus dem Reaktionsgemisch zu entziehen. In diesem Zusammenhang kann auf die Prinzipien der grünen Chemie eingegangen werden- Recycling von Reagenzien.
Die Lösung zur fakultativen Aufgabe zur Stöchiometrie ist beigefügt. Zudem ist auch eine Vorgabe für ein ausführliches Laborprotokoll beigefügt.
Beschreibung
Die Estersynthese ist eine Gleichgewichtsreaktion, weshalb wir nicht 100% Produkte als Ausbeute erhalten können. Ab einer bestimmten Konzentration an Produkten von Ester- Verbindungen und Wasser stellt sich ein dynamisches Gleichgewicht ein und die Estersynthese läuft genauso schnell wie die Rückreaktion ab, bei der in einer Esterhydrolyse der Ester wieder zur Carbonsäure und Alkohol gespalten wird.
Wir können nun mehr Produkt erhalten, wenn wir eines der Produkte aus dem Reaktionsgemisch entfernen. Abgesehen vom Ester entsteht auch Wasser. Wenn Wasser aus dem Reaktionsgemisch entfernt wird, dann fehlt ein Reaktionspartner für die Esterhydrolyse und wir erhalten mehr Ester-Verbindungen.
Materialinformationen
Material herunterladen
docx Herunterladen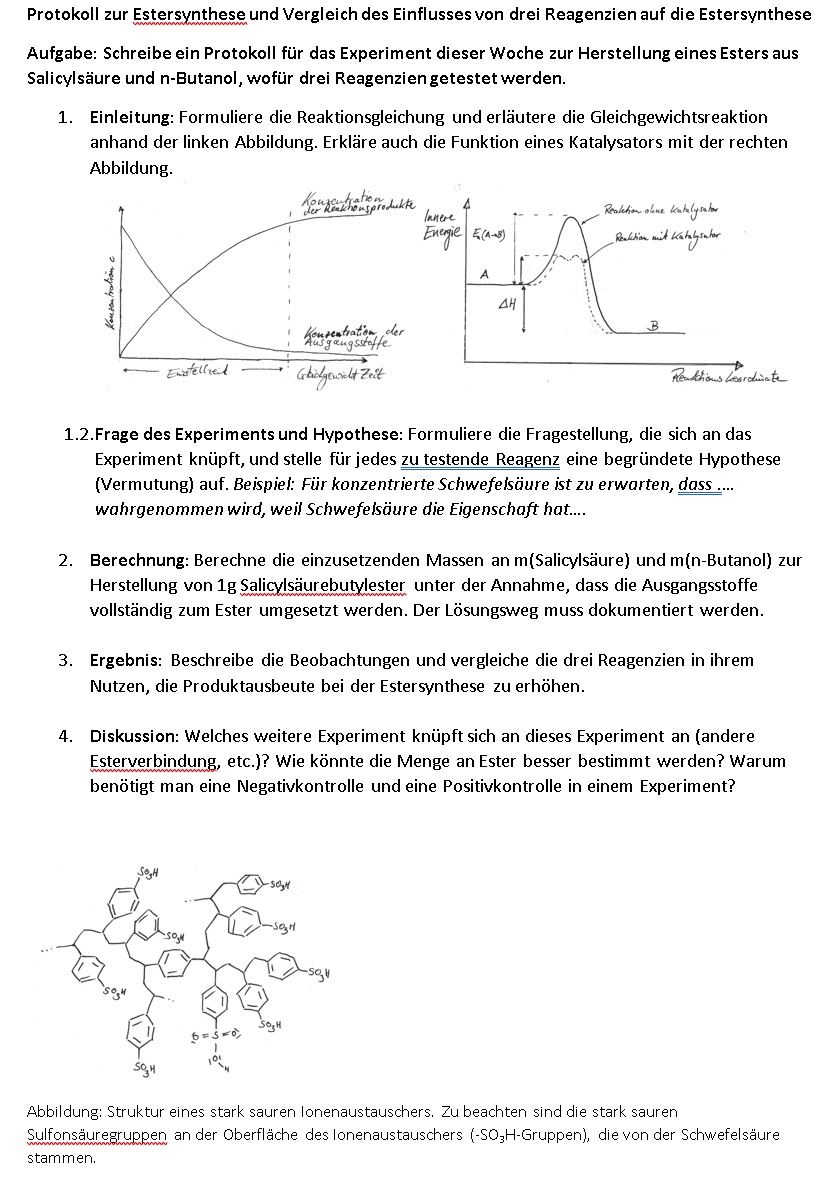
: Formuliere die Reaktionsgleichung und erläutere die Gleichgewichtsreaktion anhand der linken Abbildung. Erkläre auch die Funktion eines Katalysators mit der rechten Abbildung.